1969年,神经科学学会(Society for Neuroscience, SfN),作为一个联结各领域神经科学家的组织,正式成立。学会成立50周年之际,其培训顾问委员会(Trainee Advisory Committee)写下此文回顾此前50年神经科学的重要研究,并展望未来50年可能出现的新成果。
细胞与分子神经生物学
过去的50年里,随着膜片钳电生理、PCR和基因组测序等技术的出现,人们对于思维、欲望和行为的细胞和分子过程有了进一步的认识。学会认为在接下来的50年中,技术上会出现更大的进步,概念上会达成更多共识。这些进步将有助于回答下列问题:大脑数几百亿单独神经元如何共同工作以产生行为?什么样的脑内改变会导致疾病?什么造就了人类大脑的独特性?
回答这些问题的两个关键是完善的连接组学研究和哺乳动物脑细胞综合图谱。同时,正在发展的单细胞转录组学/蛋白组学技术将揭示不同种生物间脑细胞的多样性[1][2]。结合自动化高通量技术和创新视觉电生理技术[3][4],神经科学将开始探索不同的细胞群是如何实现发育过程和生理功能上的不同。如此我们将不仅能鉴定不同类型细胞在正常和病态大脑中的作用,还能发现将人和其它哺乳动物区别开的细胞机理。这些方法获得的数据将通过光遗传学[5]、化学遗传学[6]和基因编码的钙指示剂可视化[7]等新近发明的手段分析来探测、扰动并界定不同的细胞群。
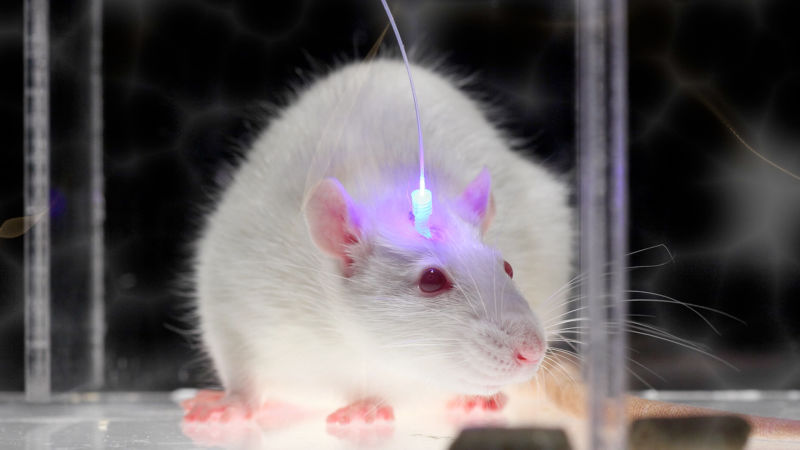
细胞的分子组成复杂而多样,在疾病诱导的分子变化探测上,现有的手段费力且不精确。未来50年里显微技术的发展[8]将使研究者以前所未有的分辨率观察亚细胞体系,增强我们对分子互作的认识。能够在生物体内检测并调控表观遗传过程和分子终端的工具的出现,将使我们能够理解表观遗传基因组、基因组、转录组和蛋白组的变化与行为的联系[9]。活体实验的结果将辅以用干细胞诱导的类脑器官研究的结果。这种类脑器官是一种发育中的人脑模型,在新的分子和成像技术的协助下,我们有望发现人脑发育早期特定类群细胞的功能。今后50年的研究将进一步帮助我们理解突触形成和其受信号通路、可塑性机制、胶质细胞等非神经元因素调控的过程(Dityatev et al., 2010) [10][11][12]。
以上许多新技术的应用将依赖于新型细胞靶向技术。这一技术将简化精确调控神经通路、基因治疗和药物递送的过程。随着表征大脑健康的生物标记物的发现,这些进展有望大幅度加深我们对脑部疾病的认识,并开创出新的疗法。
发育神经生物学
建立在细胞与分子神经生物学的基础之上,发育神经生物学研究内部和外部因素如何影响神经元,神经回路和大脑发育的进程,进而影响疾病风险和人的行为。神经发育的研究范围小到细胞内的生化过程,大到大脑在长达几十年的过程中会发生什么样的变化。虽然有诸多有前景的领域,我们认为在接下来的半个世纪中重要成果将出现在单个细胞分化、神经元发生和类器官等方向。
神经元的基因表达特性是研究特定细胞命运,迁移路径和连接方式的基础。另外,通过全基因组测序检测体细胞突变来确定细胞谱系[13][14]将发现人类和其他物种脑细胞分布的异同。Brainbow是一种选择性标记分化和增殖神经元的技术[15][16],以Brainbow为基础的新技术能够让研究人员监控神经祖细胞以及其如何形成复杂回路以构成神经系统。
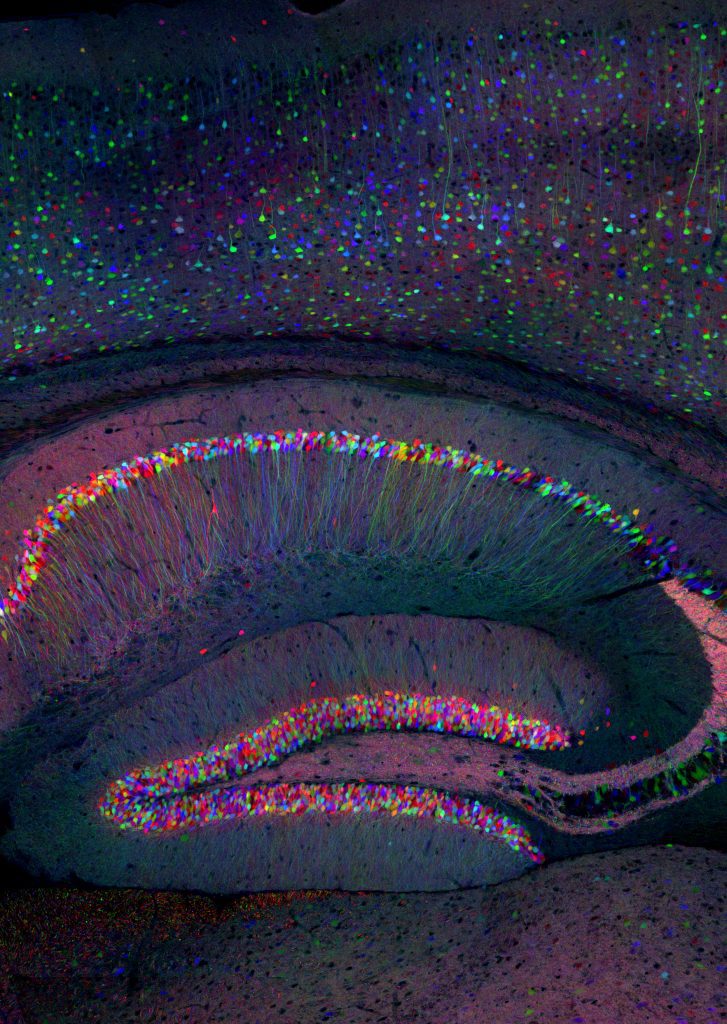
过去的50年里,神经科学就成年人脑中是否有神经元再生争论不休。这一极具争议性的问题最初出现在神经科学学会成立之前的1969年[17],但直到20世纪八九十年代才引起人们的关注。当时有越来越多的研究称在包括人类在内的许多物种的脑室下区和颗粒下层发现了新生细胞[18][19][20]。虽然有令人信服的证据,辩论仍在进行:近期的研究成果表明至少在成年灵长类动物中海马体中的神经再生不发生或极少发生[21]。但是,一项更新的研究表明健康的老年个体海马体中有稳定的神经再生[22][23],给这一问题增添了争议性。这一持续不断的争议或许与处理尸体组织时使用不同固定方法的技术限制有关,可能是检测了错误的神经干细胞标记物,或者是只研究了啮齿动物模型。在下一个50年里,我们希望新技术能最终在体内用非入侵性成像技术标记新生神经元,或在不同哺乳动物的体外样本中发现新生神经元。为解决这一问题所做的努力能让我们更加深刻地理解灵长类动物中大脑皮层发育的复杂机制。另外,通过分析发育中神经元的各种组学研究结果,我们期待能够发明精确控制神经发生的方法以调控疾病进程,并理解神经发生在心理学和神经疾病中的作用。
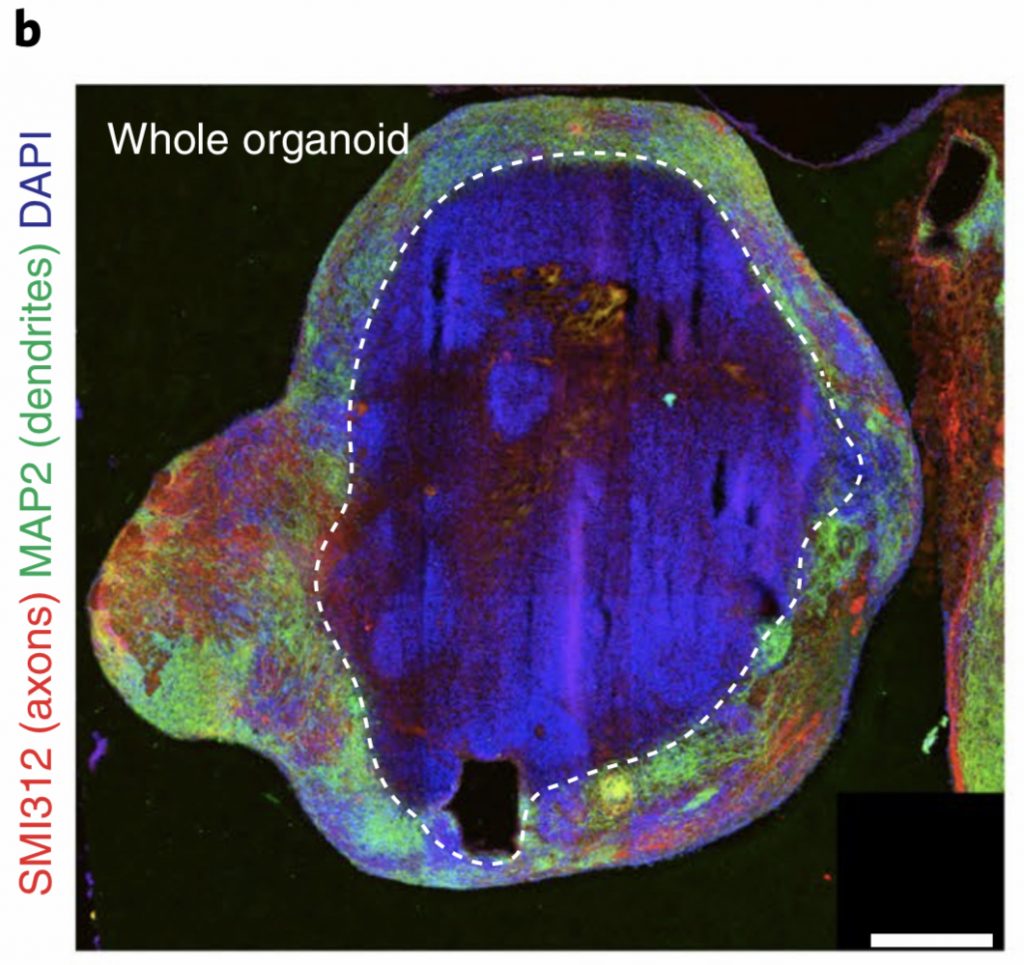
自2013出现以来,类脑器官成为了一种神经科学家用于研究包括发育和衰老在内的无数过程的模型[24][25][26][27]。虽然我们已经提出了制造类脑器官和诱导多能干细胞的方法[28][29][30],一些方法论上的缺陷阻碍了它们发挥全部潜能。[31][32][33]。后续的技术进步将解决类脑器官中血管和支撑结构的问题,使类脑器官能够更大更快地生长,在复杂性上更加接近发育中的人脑。这些发展将开启一个体外研究的新时代,让研究人员能研究发育神经生物学的各个方面。结合活细胞成像技术,类脑器官能极大加速对驱动细胞命运、神经元迁移和突出延伸的复杂信号模式的研究。为系统建模等用途而发明的计算方法目前仅被应用在发育神经生物学中,但这些方法将使研究人员能够研究时间和空间上似乎无穷的不同信号的复杂相互作用,这些信号决定细胞命运,神经元迁移和神经回路的形成,但至今大多仍只被单独研究。使用病毒方法测量和操控神经元活动的类脑器官实验将是研究神经回路形成和维持中经验依赖可塑性的关键。伴随着体内操控细胞结构技术的发展[34],神经科学家会更好地理解突触形成的机制,并将结构可塑性与突触可塑性和行为连接起来。
除了加深我们对神经发育的理解,类脑器官为研究人员提供了研究人脑独特性的体系,使其能研究自闭症和精神分裂症等难以在动物模型中研究的疾病[35]。具有形成持续数月甚至数年的功能性回路能力后,神经科学家通过比较健康细胞系和遗传缺陷细胞系对时间和环境压力因素的响应,将能研究基因、年龄和环境对大脑功能的影响。最终,类脑器官将成为筛选神经药物和测试基因疗法的效果的标准模型,并进一步使人研究出通过自发脑组织替换技术恢复受伤大脑的方法。
从神经系统到行为
过去,神经科学家采用还原论的方法来理解人脑的功能。现代科学对人脑的认知从1909年的47个脑区已经发展到了现在仅大脑皮层就有98个区域[36]。最初,神经科学家只能采用切除和药理学方法研究动物大脑特定区域的功能。但在过去的二十年里,新的遗传学方法使得研究人员能够在动物模型中更加精确地操纵神经回路。对这些回路的研究加深了人们对于感知处理、运动控制和记忆的理解。由于至今大多研究研只在隔离情况下研究这些回路,所以我们对多脑区和回路相互作用下产生行为过程的理解仍然有限。比如,运动控制、感知处理和决策制定的回路如何相互作用?感知处理如何影响准备好的行为?
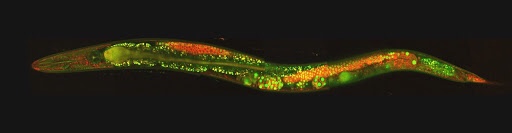
鉴于我们已经理解了大脑中的一些系统是如何单独工作的,也发明了更好的手段在时间和空间上监控和操控神经元的活动,下一步要做的便是破解成群的神经元和相距较远的脑区如何协同运作产生行为。高密度多点电极将在这个问题中发挥关键作用。另外,虚拟现实环境、基于模型的分析方法和人工智能等技术与新的记录和调控方法的结合可以用于研究多感知传入如何整合并转化为输出为行为(比如动作、思考和决策等)。利用斑马鱼和秀丽隐杆线虫,研究人员可以在监控行为的同时对其神经系统的活动进行成像,这一方法将被用于研究多种功能回路如何串联[37]。随着高密度电极和其它方法被用于越来越多的神经元成像,我们应该把重点放在破解这些神经元整体在编码什么,而不只是任务响应型神经元或支持特定假说的神经元。为了解答这一问题,统计和计算方法,例如机器学习将变的十分重要,并在神经工程学中开拓新的领域。
近些年,病毒介导的基因编辑技术允许我们在活体内进行光学测量,和操控所选的神经元的发展。这对于系统神经生物学家来说是一大福利。这些新技术将基于回路的实验推进到了聚光灯下,并正在快速阐明神经元的相互连接和特定神经元组的作用。在接下来的50年中,它们将在理解神经元集群如何指导行为[38],甚至是意识中起重要作用。意识是对大脑深度研究的一个重要课题,因为这种对自身和周遭世界的感知可能驱动着认知功能(比如策划行为和决策制定),并被疾病和其他影响大脑的情况所调控。利用最近实现的细胞分辨人脑功能成像技术 [39],认知神经科学家将开始解锁认识仍旧不充分的特定脑区的复杂性,例如小脑、前额叶皮层和海马体,以及多个脑区如何互相合作。比如,更高分辨率的人脑成像技术将使对回路功能的新认识为神经调节干预(例如经颅磁刺激和超声神经调节)铺平道路。这些基于神经回路的调节方法通过调控不同功能的神经中枢,可能被用于治疗神经精神疾病[40]。
快速发展的系统神经科学受限于测量行为和将行为与神经活动相联系的方法。神经科学家研究不同功能回路的能力也受限于对行为的测量和定义,这些行为经常被人类观察者手动或半自动地定义,导致其节点被过度简化,细节被忽视[41]。另外,对动物社交行为的测量出于初级阶段。在下一个50年里,行为神经生物学使用的研究方法将越来越像功能性分离神经回路的方法。计算机视觉技术将通过全自动高通量无偏差行为分析极大地推进这一领域的研究[42][43]。现存神经精神疾病(例如焦虑症和抑郁症)的模型通常过于简单,持续稳定地检测社会环境下行为的能力将构建这些疾病的新动物模型。类似的方法(比如使用家庭实验室、线上实验室和神经反馈)在人类中[44][45]有望揭示先前未发现的疾病症状和预示疾病风险的行为指标。[46][47][48][49][50]。
最后,结合实时记录调控神经回路技术和表征行为和神经活动的一体化无偏差方法,我们将使用神经接口技术直接参与神经系统活动。这一技术的快速发展使得脑机接口能成功控制义肢,使盲人初步感知视觉图像。随着这些技术的发展,神经接口将使义肢应用更加广泛,拓宽感知反馈,还可能改善认知功能下降个体的记忆能力。
疾病
在过去的50年里,科学发现揭示了特定疾病对于神经系统功能的影响。我们庆幸人类已经度过了自闭症、抑郁症、精神分裂症和痴呆患者被羞辱,被边缘化,被特定机构收容的时代。如今,立法者和社会亟需神经科学家解释这些疾病的发病机制以及发现如何有效预防,监测和治疗。在未来的50年里,我们预测相关研究将会解决下列问题:在神经系统出现异常之前,大脑在细胞和分子层面上发生了哪些变化?我们该如何理解多因素导致的神经疾病的复杂性以开发出靶向疗法?我们要怎样早期介入以抑制症状外显及病程发展?
FDA新近批准了一系列治疗神经疾病的药物:艾氯胺酮(esketamine)用于治疗大部分抑郁症,布雷索隆(brexanolone)用于治疗产后抑郁,辛波莫德(siponimod)用于治疗多发性硬化[51]。这些药物让我们有望在50年之后进入“神经疗法”的新时代。然而与过去的药物相比,现今的新药在治疗上花的时间更长,且不容易被FDA批准。[52]。与过去30年里癌症疗法的发展类似,之后在神经疾病治疗领域的进展将多由公众和政府支持的资金推动。美国“脑计划”根本性地推动了技术的发展,这些技术在神经疾病的诊断与治疗上有深远的影响。其它针对特定疾病的项目十分有望加速研究并转化成果,例如美国卫生与公共服务部攻克阿尔兹海默病的全国计划(US Department of Health & Human Services’ National Plan to Address AD)辅以联邦基金致力于研究阿尔兹海默病的英国领导的痴呆研究计划[53]。
除了治疗上的进展之外,我们也会将生物学机制上研究应用到神经和精神疾病的诊断中。具体而言,病原学和分子机制将被纳入目前基于症状的诊断方法之中。比如使用基因鉴定诊断脊髓性肌萎缩,在不需要神经病理检测的情况下通过分子改变诊断包括阿尔兹海默症在内的痴呆病[54][55]。行为追踪器和AI等技术进步将有助于我们更好地理解正常与非正常神经系统的功能以及治疗神经疾病。AI已经在人血浆中发现了帮助诊断阿尔兹海默症的生物标记物复合体[56],这种技术将被用于分析药物疗法中药物分子与生物分子结合的效价,进而加速药物发现。另外新发现的兼容正电子断层扫描成像技术的追踪物有望成为一个极具价值的诊疗与预防措施[57]。
在治疗大脑疾病的研究上加大投入力度之外,研究如何预防这些疾病也十分必要。神经疾病在世界范围内的高发病率是社会的沉重负担。因此,发现可以通过简单的生活方式介入(锻炼、饮食、认知训练和社会参与度)降低发病风险的关键机制将是未来50年研究的重点。在遗传与环境因素方面的研究也将类似地影响未来的公共卫生政策和医疗方案。
包容的未来
显然,在未来的50年里,我们将不仅对于大脑有更加全面的理解,更将看到在神经科学领域科研方式的改变。神经科学家务必在这些改变中认识到多样性的重要性。迄今为止,研究对象多以不同物种的雄性[58]右利手个体为主。另外,绝大多数临床试验和基因研究测试的是欧洲人。这些系统性缺陷部分是由于神经科学家群体自身缺乏多样性。因此,神经科学缺乏对雌性大脑以及性别差异的了解,FDA和EMA批准的药物在非白种人群体中药效下降。展望未来,我们需要重视研究人员以及研究对象的多样性。
社会中的神经科学
神经科学产生的影响已经扩展到远超临床到教室、法庭甚至是杂货店。虽然缺乏有力证据,但神经技术有望出现在人们家中,提升人们的认知能力[59][60]。
神经教育学,一个将发育与认知神经科学和教育策略相结合的新学科[61], 使我们了解患有读写障碍,注意力缺陷多动障碍和其他疾病的学生如何学习。这些知识已经被用于制定适合这些学生的课程。但是,认知心理学和认知神经科学并没有在普通的基础教育和高等教育中得到广泛的应用[61]。进一步的研究将帮助我们决定某些数学概念应该在何时被教授,如何安排教学计划以与生物节律相协调。在接下来的50年中,我们预期神经教育学将会被更加广泛地应用。
神经科学因为被用于解释犯罪行为,在法庭上变得越来越常见[62]。其作用将随着研究人员对决策的神经机制的更加了解变得更加显著。人类神经成像技术将发展到能够帮助确认有罪甚至预测再犯的可能性。
虽然在日常生活中可能并不明显,但全世界的公司正将神经科学的结论应用到从办公室结构到市场策略等商业活动之中。随着认知神经科学的发展,这一趋势将更加明显[63]。可穿戴式神经科技产品有望迅速提供用户反馈,使商家为其制定个性化的推荐[64]。神经科学为商业公司带来利润的同时,我们也应警惕,防止其逾越伦理底线。
神经科学是一个广阔的领域。成年人的大脑中有约860亿个神经元和近乎同等数量的非神经元细胞,所以神经科学作为研究大脑的科学如此复杂也就不足为奇了。在神经系统中,神经元穿越颅骨到身体最远端的地方感受刺激并作出反应,神经科学将始终尝试理解这一过程并开发其无尽的潜力。
除了研究神经系统本身,我们也应该思考如何组织优化现有的研究体系。借鉴空间科学的发展,我们认为跨学科的研究手段是神经科学持续发展的关键。目前神经科学的研究由若干国家的若干机构资助,但不同国家的研究机构合力完成大规模,跨领域项目的例子正在逐渐变多。比如脑计划和人类脑计划就资助着来自各个学科的科学家们研究人脑。
神经科学学会年会的参与者已从最初的1395人发展到了超过3万人,其旺盛的生命力照实了它作为开展科学交流与合作高地的价值[65]。随着神经科学对于未知的不断探索,学会团结各科学家并协调其工作的功能将在对人脑的研究中发挥愈加重要的作用。
原文来源:
The Next 50 Years of Neuroscience
Cara M. Altimus, Bianca Jones Marlin, Naomi Ekavi Charalambakis, Alexandra Colón-Rodriquez, Elizabeth J. Glover, Patricia Izbicki, Anthony Johnson, Mychael V. Lourenco, Ryan A. Makinson, Joseph McQuail, Ignacio Obeso, Nancy Padilla-Coreano, Michael F. Wells and for Training Advisory CommitteeJournal of Neuroscience 2 January 2020, 40 (1) 101-106; DOI: https://doi.org/10.1523/JNEUROSCI.0744-19.2019
参考文献
[1]Saunders A, Macosko EZ, Wysoker A, Goldman M, Krienen FM, de Rivera H, Bien E, Baum M, Bortolin L, Wang S, Goeva A, Nemesh J, Kamitaki N, Brumbaugh S, Kulp D, McCarroll SA (2018) Molecular diversity and specializations among the cells of the adult mouse brain. Cell 174:1015–1030.e16. doi:10.1016/j.cell.2018.07.028 pmid:30096299
[2]Wang X, Allen WE, Wright MA, Sylwestrak EL, Samusik N, Vesuna S, Evans K, Liu C, Ramakrishnan C, Liu J, Nolan GP, Bava FA, Deisseroth K (2018) Three-dimensional intact-tissue sequencing of single-cell transcriptional states. Science 361:eaat5691. doi:10.1126/science.aat5691 pmid:29930089
[3]Priest BT, Cerne R, Krambis MJ, Schmalhofer WA, Wakulchik M, Wilenkin B, Burris KD (2004) Automated electrophysiology assays. In: Assay guidance manual (Sittampalam GS, Coussens NP, Brimacombe K, Grossman A, Arkin M, Auld D, Austin C, et al., eds). Bethesda, MD: Eli Lilly and the National Center for Advancing Translational Sciences.
[4]Zhang H, Reichert E, Cohen AE (2016) Optical electrophysiology for probing function and pharmacology of voltage-gated ion channels. Elife 5:e15202. doi:10.7554/eLife.15202 pmid:27215841
[5]Boyden ES (2011) A history of optogenetics: the development of tools for controlling brain circuits with light. F1000 Biol Rep 3:11. doi:10.3410/B3-11 pmid:21876722
[6]Sternson SM, Roth BL (2014) Chemogenetic tools to interrogate brain functions. Annu Rev Neurosci 37:387–407. doi:10.1146/annurev-neuro-071013-014048 pmid:25002280
[7]Resendez SL, Stuber GD (2015) In vivo calcium imaging to illuminate neurocircuit activity dynamics underlying naturalistic behavior. Neuropsychopharmacology 40:238–239. doi:10.1038/npp.2014.206 pmid:25482169
[8]Gao R, Asano SM, Upadhyayula S, Pisarev I, Milkie DE, Liu TL, Singh V, Graves A, Huynh GH, Zhao Y, Bogovic J, Colonell J, Ott CM, Zugates C, Tappan S, Rodriguez A, Mosaliganti KR, Sheu SH, Pasolli HA, Pang S, et al. (2019) Cortical column and whole-brain imaging with molecular contrast and nanoscale resolution. Science 363:eaau8302. doi:10.1126/science.aau8302 pmid:30655415
[9]Hayashi-Takagi A, Yagishita S, Nakamura M, Shirai F, Wu YI, Loshbaugh AL, Kuhlman B, Hahn KM, Kasai H (2015) Labelling and optical erasure of synaptic memory traces in the motor cortex. Nature 525:333–338. doi:10.1038/nature15257 pmid:26352471
[10]Prinz M, Priller J (2014) Microglia and brain macrophages in the molecular age: from origin to neuropsychiatric disease. Nat Rev Neurosci 15:300–312. doi:10.1038/nrn3722 pmid:24713688
[11]Fields RD (2015) A new mechanism of nervous system plasticity: activity-dependent myelination. Nat Rev Neurosci 16:756–767. doi:10.1038/nrn4023 pmid:26585800
[12]Ben Haim L, Rowitch DH (2017) Functional diversity of astrocytes in neural circuit regulation. Nat Rev Neurosci 18:31–41. doi:10.1038/nrn.2016.159 pmid:27904142
[13]Evrony GD, Lee E, Mehta BK, Benjamini Y, Johnson RM, Cai X, Yang L, Haseley P, Lehmann HS, Park PJ, Walsh CA (2015) Cell lineage analysis in human brain using endogenous retroelements. Neuron 85:49–59. doi:10.1016/j.neuron.2014.12.028 pmid:25569347
[14]Lodato MA, Woodworth MB, Lee S, Evrony GD, Mehta BK, Karger A, Lee S, Chittenden TW, D’Gama AM, Cai X, Luquette LJ, Lee E, Park PJ, Walsh CA (2015) Somatic mutation in single human neurons tracks developmental and transcriptional history. Science 350:94–98. doi:10.1126/science.aab1785 pmid:26430121
[15]Gomez-Nicola D, Riecken K, Fehse B, Perry VH (2014) In-vivo RGB marking and multicolour single-cell tracking in the adult brain. Sci Rep 4:7520. doi:10.1038/srep07520 pmid:25531807
[16]Loulier K, Barry R, Mahou P, Le Franc Y, Supatto W, Matho KS, Ieng S, Fouquet S, Dupin E, Benosman R, Chédotal A, Beaurepaire E, Morin X, Livet J (2014) Multiplex cell and lineage tracking with combinatorial labels. Neuron 81:505–520. doi:10.1016/j.neuron.2013.12.016 pmid:24507188
[17]Altman J (1962) Are new neurons formed in the brains of adult mammals? Science 135:1127–1128. doi:10.1126/science.135.3509.1127 pmid:13860748
[18]Eriksson PS, Perfilieva E, Björk-Eriksson T, Alborn AM, Nordborg C, Peterson DA, Gage FH (1998) Neurogenesis in the adult human hippocampus. Nat Med 4:1313–1317. doi:10.1038/3305 pmid:9809557
[19]Knoth R, Singec I, Ditter M, Pantazis G, Capetian P, Meyer RP, Horvat V, Volk B, Kempermann G (2010) Murine features of neurogenesis in the human hippocampus across the lifespan from 0 to 100 years. PLoS One 5:e8809. doi:10.1371/journal.pone.0008809 pmid:20126454
[20]Spalding KL, Bergmann O, Alkass K, Bernard S, Salehpour M, Huttner HB, Boström E, Westerlund I, Vial C, Buchholz BA, Possnert G, Mash DC, Druid H, Frisén J (2013) Dynamics of hippocampal neurogenesis in adult humans. Cell 153:1219–1227. doi:10.1016/j.cell.2013.05.002 pmid:23746839
[21]Sorrells SF, Paredes MF, Cebrian-Silla A, Sandoval K, Qi D, Kelley KW, James D, Mayer S, Chang J, Auguste KI, Chang EF, Gutierrez AJ, Kriegstein AR, Mathern GW, Oldham MC, Huang EJ, Garcia-Verdugo JM, Yang Z, Alvarez-Buylla A (2018) Human hippocampal neurogenesis drops sharply in children to undetectable levels in adults. Nature 555:377–381. doi:10.1038/nature25975 pmid:29513649
[22]Boldrini M, Fulmore CA, Tartt AN, Simeon LR, Pavlova I, Poposka V, Rosoklija GB, Stankov A, Arango V, Dwork AJ, Hen R, Mann JJ (2018) Human hippocampal neurogenesis persists throughout aging. Cell Stem Cell 22: 589–599.e5. pmid:29625071
[23]Moreno-Jiménez EP, Flor-García M, Terreros-Roncal J, Rábano A, Cafini F, Pallas-Bazarra N, Ávila J, Llorens-Martín M (2019) Adult hippocampal neurogenesis is abundant in neurologically healthy subjects and drops sharply in patients with Alzheimer’s disease. Nat Med 25:554–560. doi:10.1038/s41591-019-0375-9 pmid:30911133
[24] Lancaster MA, Renner M, Martin CA, Wenzel D, Bicknell LS, Hurles ME, Homfray T, Penninger JM, Jackson AP, Knoblich JA (2013) Cerebral organoids model human brain development and microcephaly. Nature 501:373–379. doi:10.1038/nature12517 pmid:23995685
[25]Gonzalez C, Armijo E, Bravo-Alegria J, Becerra-Calixto A, Mays CE, Soto C (2018) Modeling amyloid beta and tau pathology in human cerebral organoids. Mol Psychiatry 23:2363–2374. doi:10.1038/s41380-018-0229-8 pmid:30171212
[26]Karzbrun E, Reiner O (2019) Brain organoids: a bottom-up approach for studying human neurodevelopment. Bioengineering (Basel) 6:E9. doi:10.3390/bioengineering6010009 pmid:30669275
[27]Pollen AA, Bhaduri A, Andrews MG, Nowakowski TJ, Meyerson OS, Mostajo-Radji MA, Di Lullo E, Alvarado B, Bedolli M, Dougherty ML, Fiddes IT, Kronenberg ZN, Shuga J, Leyrat AA, West JA, Bershteyn M, Lowe CB, Pavlovic BJ, Salama SR, Haussler D, et al. (2019) Establishing cerebral organoids as models of human-specific brain evolution. Cell 176: 743–756.e17. pmid:30735633
[28]Lancaster MA, Renner M, Martin CA, Wenzel D, Bicknell LS, Hurles ME, Homfray T, Penninger JM, Jackson AP, Knoblich JA (2013) Cerebral organoids model human brain development and microcephaly. Nature 501:373–379. doi:10.1038/nature12517 pmid:23995685
[29]Sloan SA, Darmanis S, Huber N, Khan TA, Birey F, Caneda C, Reimer R, Quake SR, Barres BA, Pasca SP (2017) Human astrocyte maturation captured in 3D cerebral cortical spheroids derived from pluripotent stem cells. Neuron 95:779–790.e6. doi:10.1016/j.neuron.2017.07.035 pmid:28817799
[30]Karzbrun E, Reiner O (2019) Brain organoids: a bottom-up approach for studying human neurodevelopment. Bioengineering (Basel) 6:E9. doi:10.3390/bioengineering6010009 pmid:30669275
[31]Karzbrun E, Reiner O (2019) Brain organoids: a bottom-up approach for studying human neurodevelopment. Bioengineering (Basel) 6:E9. doi:10.3390/bioengineering6010009 pmid:30669275
[32]Yakoub AM (2019) Cerebral organoids exhibit mature neurons and astrocytes and recapitulate electrophysiological activity of the human brain. Neural Regen Res 14:757–761. doi:10.4103/1673-5374.249283 pmid:30688257
[33]Yoon SJ, Elahi LS, Pasca AM, Marton RM, Gordon A, Revah O, Miura Y, Walczak EM, Holdgate GM, Fan HC, Huguenard JR, Geschwind DH, Pasca SP (2019) Reliability of human cortical organoid generation. Nat Methods 16:75–78. doi:10.1038/s41592-018-0255-0 pmid:30573846
[34]Hayashi-Takagi A, Yagishita S, Nakamura M, Shirai F, Wu YI, Loshbaugh AL, Kuhlman B, Hahn KM, Kasai H (2015) Labelling and optical erasure of synaptic memory traces in the motor cortex. Nature 525:333–338. doi:10.1038/nature15257 pmid:26352471
[35]Di Lullo E, Kriegstein AR (2017) The use of brain organoids to investigate neural development and disease. Nat Rev Neurosci 18:573–584. doi:10.1038/nrn.2017.107 pmid:28878372
[36]Glasser MF, Coalson TS, Robinson EC, Hacker CD, Harwell J, Yacoub E, Ugurbil K, Andersson J, Beckmann CF, Jenkinson M, Smith SM, Van Essen DC (2016) A multi-modal parcellation of human cerebral cortex. Nature 536:171–178. doi:10.1038/nature18933 pmid:27437579
[37]Cong L, Wang Z, Chai Y, Hang W, Shang C, Yang W, Bai L, Du J, Wang K, Wen Q (2017) Rapid whole brain imaging of neural activity in freely behaving larval zebrafish (Danio rerio). Elife 6:e28158. doi:10.7554/eLife.28158 pmid:28930070
[38]Jennings JH, Kim CK, Marshel JH, Raffiee M, Ye L, Quirin S, Pak S, Ramakrishnan C, Deisseroth K (2019) Interacting neural ensembles in orbitofrontal cortex for social and feeding behaviour. Nature 565:645–649. doi:10.1038/s41586-018-0866-8 pmid:30651638
[39]Koopmans PJ, Yacoub E (2019) Strategies and prospects for cortical depth dependent T2 and T2* weighted BOLD fMRI studies. Neuroimage 197:668–676. doi:10.1016/j.neuroimage.2019.03.024 pmid:30904468
[40]Diana M, Raij T, Melis M, Nummenmaa A, Leggio L, Bonci A (2017) Rehabilitating the addicted brain with transcranial magnetic stimulation. Nat Rev Neurosci 18:685–693. doi:10.1038/nrn.2017.113 pmid:28951609
[41]Anderson DJ, Perona P (2014) Toward a science of computational ethology. Neuron 84:18–31. doi:10.1016/j.neuron.2014.09.005 pmid:25277452
[42]Wiltschko AB, Johnson MJ, Iurilli G, Peterson RE, Katon JM, Pashkovski SL, Abraira VE, Adams RP, Datta SR (2015) Mapping sub-second structure in mouse behavior. Neuron 88:1121–1135. doi:10.1016/j.neuron.2015.11.031 pmid:26687221
[43]Mathis A, Mamidanna P, Cury KM, Abe T, Murthy VN, Mathis MW, Bethge M (2018) DeepLabCut: markerless pose estimation of user-defined body parts with deep learning. Nat Neurosci 21:1281–1289. doi:10.1038/s41593-018-0209-y pmid:30127430
[44]Awolusi I, Marks E, Hallowell M (2018) Wearable technology for personalized construction safety monitoring and trending: review of applicable devices. Automation Construction 85:96–106. doi:10.1016/j.autcon.2017.10.010
[45]Marins T, Rodrigues EC, Bortolini T, Melo B, Moll J, Tovar-Moll F (2019) Structural and functional connectivity changes in response to short-term neurofeedback training with motor imagery. Neuroimage 194:283–290. doi:10.1016/j.neuroimage.2019.03.027 pmid:30898654
[46]Anderson DJ, Perona P (2014) Toward a science of computational ethology. Neuron 84:18–31. doi:10.1016/j.neuron.2014.09.005 pmid:25277452
[47]Wiltschko AB, Johnson MJ, Iurilli G, Peterson RE, Katon JM, Pashkovski SL, Abraira VE, Adams RP, Datta SR (2015) Mapping sub-second structure in mouse behavior. Neuron 88:1121–1135. doi:10.1016/j.neuron.2015.11.031 pmid:26687221
[48]Cong L, Wang Z, Chai Y, Hang W, Shang C, Yang W, Bai L, Du J, Wang K, Wen Q (2017) Rapid whole brain imaging of neural activity in freely behaving larval zebrafish (Danio rerio). Elife 6:e28158. doi:10.7554/eLife.28158 pmid:28930070
[49]Mathis A, Mamidanna P, Cury KM, Abe T, Murthy VN, Mathis MW, Bethge M (2018) DeepLabCut: markerless pose estimation of user-defined body parts with deep learning. Nat Neurosci 21:1281–1289. doi:10.1038/s41593-018-0209-y pmid:30127430
[50]Jennings JH, Kim CK, Marshel JH, Raffiee M, Ye L, Quirin S, Pak S, Ramakrishnan C, Deisseroth K (2019) Interacting neural ensembles in orbitofrontal cortex for social and feeding behaviour. Nature 565:645–649. doi:10.1038/s41586-018-0866-8 pmid:30651638
[51]Urquhart L (2019) FDA new drug approvals in Q1 2019. Nat Rev Drug Discov. Advance online publication. Retrieved Apr 10, 2019. doi: 10.1038/d41573-019-00070-3. doi:10.1038/d41573-019-00070-3 pmid:31048810
[52]Gaffney A (2014) Report finds FDA slow to approve CNS drugs, but getting faster. November 5, 2014. https://www.raps.org/regulatory-focus%E2%84%A2/news-articles/2014/11/report-finds-fda-slow-to-approve-cns-drugs,-but-getting-faster.
[53]Fox NC, Petersen RC (2013) The G8 dementia research summit-a starter for eight? Lancet 382:1968–1969. doi:10.1016/S0140-6736(13)62426-5 pmid:24332306
[54]Jack CR Jr., Vemuri P (2018) Amyloid-β: a reflection of risk or a preclinical marker? Nat Rev Neurol 14:319–320. doi:10.1038/s41582-018-0008-9 pmid:29713016
[55]Khachaturian AS, Hayden KM, Mielke MM, Tang Y, Lutz MW, Gustafson DR, Kukull WA, Mohs R, Khachaturian ZS (2018) Future prospects and challenges for Alzheimer’s disease drug development in the era of the NIA-AA research framework. Alzheimers Dement 14:532–534. doi:10.1016/j.jalz.2018.03.003 pmid:29653605
[56]Ashton NJ, Alejo J, Nevado-Holgado AJ, Barber IS, Lynham S, Gupta V, Chatterjee P, Goozee K, Hone E, Pedrini S, Blennow K, Schöll M, Zetterberg H, Ellis KA, Bush AI, Rowe CC, Villemagne VL, Ames D, Masters CL, Aarsland D, Powell J, et al. (2019) A plasma protein classifier for predicting amyloid burden for preclinical Alzheimer’s disease. Sci Adv 5:eaau7220. doi:10.1126/sciadv.aau7220 pmid:30775436
[57]Leuzy A, Heurling K, Ashton NJ, Schöll M, Zimmer ER (2018) In vivo detection of Alzheimer’s disease. Yale J Biol Med 91:291–300. pmid:30258316
[58]Shansky RM (2019) Are hormones a ‘female problem’ for animal research? Science 364:825–826. doi:10.1126/science.aaw7570 pmid:31147505
[59]Nelson J, McKinley RA, Phillips C, McIntire L, Goodyear C, Kreiner A, Monforton L (2016) The effects of transcranial direct current stimulation (TDCS) on multitasking throughput capacity. Front Hum Neurosci 10:589. doi:10.3389/fnhum.2016.00589 pmid:27965553
[60]Schuijer JW, de Jong IM, Kupper F, van Atteveldt NM (2017) Transcranial electrical stimulation to enhance cognitive performance of healthy minors: a complex governance challenge. Front Hum Neurosci 11:142. doi:10.3389/fnhum.2017.00142 pmid:28396631
[61]Sigman M, Peña M, Goldin AP, Ribeiro S (2014) Neuroscience and education: prime time to build the bridge. Nat Neurosci 17:497–502. doi:10.1038/nn.3672 pmid:24671066
[62]Ward T, Wilshire C, Jackson L (2018) The contribution of neuroscience to forensic explanation. Psychol Crime Law 24:195–209. doi:10.1080/1068316X.2018.1427746
[63]Gottlieb J, Oudeyer PY (2018) Towards a neuroscience of active sampling and curiosity. Nat Rev Neurosci 19:758–770. doi:10.1038/s41583-018-0078-0 pmid:30397322
[64]Awolusi I, Marks E, Hallowell M (2018) Wearable technology for personalized construction safety monitoring and trending: review of applicable devices. Automation Construction 85:96–106. doi:10.1016/j.autcon.2017.10.010
[65]Fields RD (2018) The first Annual Meeting of the Society for Neuroscience, 1971: reflections approaching the 50th anniversary of the Society’s formation. J Neurosci 38:9311–9317. doi:10.1523/JNEUROSCI.3598-17.2018 pmid:30242052
编译:郑宸;编辑:阿莫東森





