导语 / Introduction
神经元周边基质网,这个将特定神经元整合到位的刚性结构,影响到的大脑活动出乎意料得多,其中一些与慢性疼痛相关。
被大脑工作机制深深吸引着的神经科学家们,自然会密切关注着神经元——这些能够通过电刺激向彼此传递感知和思想信息的细胞。除此之外,介于神经元之间的一种物质同样值得研究——那就是神经元外部有粘性的覆盖层,大致等同于鼻子和关节中的软骨。这种物质像渔网一样依附于一部分神经元,因而被叫做神经元周边基质网(PNNs)。它们由依附于细胞外蛋白支架的糖分子长链构成,将神经元固定于所在的位置,以防神经元长出界并形成新的连接。
由于这种特殊的能力,这一鲜为人知的神经覆盖层能够为一些最令人困惑的关于大脑的问题提供答案:为什么年轻的大脑更容易接受新鲜信息?为什么伴有创伤后应激障碍(PTSD)的恐惧记忆如此难以忘却?为什么产生酒精依赖之后就会很难停止饮酒?根据麦吉尔大学(McGill University)的神经科学家阿卡迪·肯塔斯基(Arkady Khoutorsky)和他同事们的研究[1],我们现在已经知道PNNs也能解释疼痛何以在神经损伤之后扩大并持存。

论文题目:
Microglia-mediated degradation of perineuronal nets promotes pain
DOI:
https://doi.org/10.1126/science.abl6773
神经可塑性是指神经网络所具有的可变性,这是一种对人生中的经历做出相对应的改变或在大脑损伤后自我修复的能力。毫不费力地改变的机会被称作神经网络的关键期,通常出现在生命早期。想想,婴儿牙牙学语有多快,而人到成年后再学一门外语又有多难。某种程度上,这正是我们想要的:允许我们理解母语的复杂神经网络在大脑中形成之后,该网络需要被锁定,以在余生中都免受侵扰。
这意味着,在关键期之后,神经网络会开始抵抗变化,而神经元周边基质网在这一过程中起到了重要作用。在关键期最后,它们会覆盖神经元并锁定神经网络的连接。这一过程一般发生在2到8岁之间。此外,神经元周边基质网还与成年后难以改变的行为习惯和长期记忆的形成有关。如果可以延长或重新开启关键期,我们的神经可塑性便能促进创伤后的恢复并逆转那些顽固又难治的神经性疾病。
近期研究表明,仅控制PNNs就可以完成上述目标。例如,当一只动物持续处于黑暗环境中时,其视觉神经元周围的神经元周边基质的发展会放缓,这样,神经元可塑性的关键期也会持续更长时间,使之可以矫正视力问题。化学物质和基因控制也能使神经元周边基质网退化并重新开启关键期,研究者就是以这样的方式让患有PTSD的老鼠忘记那些创伤性记忆(这里指声音信号后立即被电击的记忆)。与此同时,PNNs的生长也是可促进的。过度饮酒会导致与成瘾相关的PNNs的形成。研究者认为这一覆盖层能够保护神经元免受酒精中化学毒物的侵害,但过度饮酒的思维模式也同样在这一过程中被锁定了。
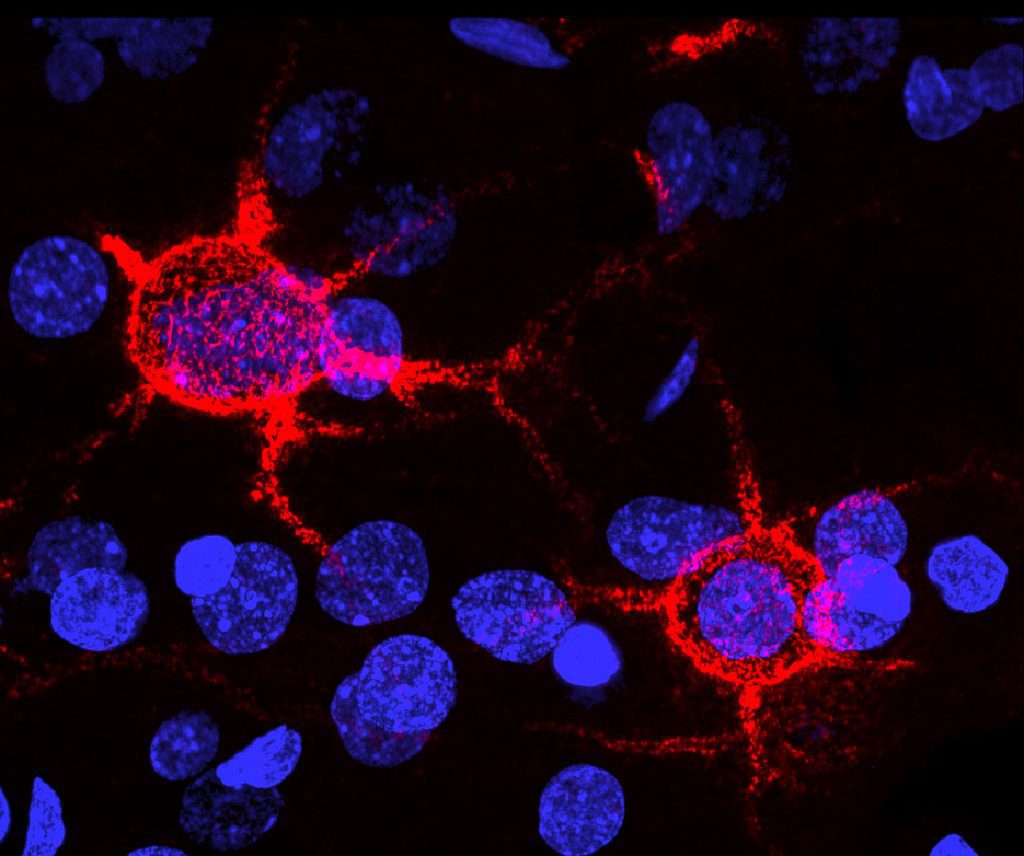
PNNs(红色)包围了老鼠大脑中的神经元(原子核染为蓝色)。新的研究表明,脊髓中相似的网络会在大脑接收疼痛时起到调节作用。
—
Kuznetsova Svetlana, Melnikova Anastasiya, Arnst Nikita
尽管在过去的几十年中,神经科学家们已经对PNNs小有了解,但该结构对慢性疼痛的影响却是意外的新发现。这一发现让PNNs的作用不再局限于关键期内,因此,这不仅帮助我们更好地理解疼痛的基本科学原理,而且也让我们对PNNs本身有了更广阔的解读。
慢性疼痛会在受伤之后一直持续,这说明了神经回路一旦被改变就会难以复原。当身上有一个地方疼痛时,全身其实都在跟着一起痛。全身的痛觉神经元都会向脊髓传递神经刺激,在中转后传输给大脑。这意味着脊髓在我们的痛觉中扮演着重要的角色。的确,医生经常通过硬膜外麻醉(将麻醉剂注射到腰脊髓周围的空间来抑制神经刺激到达大脑)来减轻分娩的疼痛。
想象一下,如果神经损伤没有抑制神经传递,而是使神经元变得高度敏感。在这种情况下,轻轻一碰会引发接二连三的神经刺激传导到脊髓,表现为剧痛。过去的研究找到了几种致超敏化的机制,但没有一种提及PNNs的参与。
然而,肯塔斯基前几年在一篇论文中读到,PNNs覆盖着一个脑区的特定小神经元,疼痛信息就是在这一脑区中被传递的。这些“抑制性中间神经元”形成痛觉神经间的突触,抑制它们传递疼痛信号的能力。肯塔斯基想要知道,PNNs是否在脊髓内关键性疼痛的中继点(critical pain relay point)中发挥类似的作用,因此,他让他的研究生,香农·坦斯利(Shannon Tansley)研究这一问题。“那会儿,人类对这个课题一无所知。”肯塔斯基说道。
坦斯利的确发现了PNNs会将脊髓中某些神经元包起来,其中就有给传递大脑疼痛信号的神经元。这些神经元有长轴突(将信号传送给中下一个细胞的神经元“尾巴”),轴突从脊髓出发指向大脑。通过神经元周边基质网上的小孔洞,一系列抑制性中间神经元附着其上,抑制性神经元能够抑制长投射神经元的活动,使得即将到达大脑的信号减缩,从而钝化对疼痛的感知。令坦斯利震惊的是,只有位于脊髓中继点的抑制神经元被PNNs所覆盖。
这一发现启发了肯塔斯基的团队,研究人员在实验室老鼠身上做研究以确定这些网络是否在周边神经损伤后的慢性疼痛中起作用。他们在老鼠全身麻醉的情况下切除它们的后腿神经,即坐骨神经。这一操作模仿了人们身上的坐骨神经损伤(这一损伤会导致持续性疼痛)。数日后,肯塔斯基的团队用无害测验(non-harmful tests)测量老鼠的疼痛阈值,例如记录从受热面逃离的时间。正如人们期待的那样,团队发现老鼠展示出大幅上升的疼痛敏感性,同时,他们还发现投射神经元的PNNs消失了。就像是关键期影响PNNs的大脑变化,老鼠后肢上的神经损伤导致的突变更改了脊髓疼痛回路上的PNNs。
此后,团队弄清了导致网络毁坏的原因:小胶质细胞(microglia),即一种在大脑和脊髓中都有分布的、在伤病后开启修复的细胞。为测试小胶质细胞与疼痛之间的关联,团队转向完全没有小胶质细胞的老鼠(基因工程使之成为可能),并对它们实施了相同的手术。坐骨神经手术之后,这些老鼠的PNNs完好无损,值得注意的是,老鼠并没有变得对疼痛刺激高度敏感。为了进一步证实这一关联,研究团队用多种方式降解了网络,并发现这增强了老鼠对疼痛的敏感度。
这证明PNNs会直接抑制疼痛敏感性。通过用电极测量突触传递,肯塔斯基的团队甚至查明了这一机制的运作原理。降解PNNs会导致一串连锁反应,这串反应会使得从投射神经元发送到大脑的疼痛信号增加:当对神经损伤作出回应的小胶质细胞PNNs时,这就削弱了抑制性神经元(这些神经元通常会抑制大脑投射神经元的活动)的影响。失去抑制闸意味着失控的神经放电和剧烈的疼痛。
小胶质细胞释放出使经历神经损伤后的痛觉神经元高度敏感的物质。这种对PNNs出人意料的作用带来的最大好处是:特异度(specificity)。肯塔斯基说:“通常周边网络所做的就是锁定可变性,它们还会保护细胞。为什么这些网络只出现在疼痛中继神经元周围,却没有出现在其他(临近的)细胞类型周围呢?”他猜想,这是因为脊髓中的疼痛中继点十分重要,以至于这些神经及其连接需要额外的保护,从而使得它们对疼痛传递的控制是强有力且可靠的。因此,只有足够巨大的变化,例如神经损伤,才能破坏这种稳定性。
肯塔斯基说道:“这一机制的精妙之处在于,它是具有选择性的,即只针对特定类型的细胞。”小胶质细胞释放的物质会增加神经放电并导致神经损伤之后的疼痛,这会对附近所有类型的细胞产生影响,但PNNs只包围那些准确无误地位于脊髓关键性中继点(critical relay point)上的神经元。
为了更好地理解这一关于慢性疼痛的新机制,研究还在持续进行。如果研究者能够发展出损伤后修复PNNs的方法,这会为慢性疼痛提供新的治疗方法:考虑到目前的解决方式——麻醉剂(会随着时间的流逝失去作用,还会导致成瘾或致命的过度使用),我们急需一个新的解药。
神经元中正在发生什么自然令人着迷且须要被理解,而我们的神经网络由一个个神经元彼此连接构成,因此神经元之间被忽视的软骨组织更是至关重要。
译者:muchun;校对:胡夏天;编辑:eggriel
原文:https://www.quantamagazine.org/neuronal-scaffolding-plays-unexpected-role-in-chronic-pain-20220728/



















评论