肚子疼是一种防御机制。除了代替愤怒的胃肠道告诉你要好好对待它们以外,痛觉神经元也会介导呕吐、腹泻等反应,将脏东西赶出体外。
最近一项小鼠研究表明,早在病原体侵入以前,神经元就会与肠道细胞及微生物沟通,共同防范病原体,提早将它们拦在门外。
故事中的反派是肠道沙门氏菌(Salmonella enterica )。它们家族中的致病菌每年都导致上亿人感染肠炎或伤寒,最近几年还开始越来越不怕抗生素。这种狡猾的致病菌常常搭便车从小肠进入体腔。
这个便车是一种叫做微褶皱细胞(Microfold,简称M细胞)的免疫细胞,它们平时的工作是把肠道内的可疑抗原呈递给上级,让领导引起重视,激发特异免疫反应(specific immunity)。不少肠道致病菌总是借这个呈递过程,突破肠道屏障。
故事的主角——脊髓背角神经节(dorsal root gangaRG)中的痛觉神经元(nociceptor),不能容忍这一切的发生。通常我们认为,痛觉神经元只是负责检测伤害性的理化刺激,告诉脊髓和大脑“肚子痛啊”,让后者指挥处理。
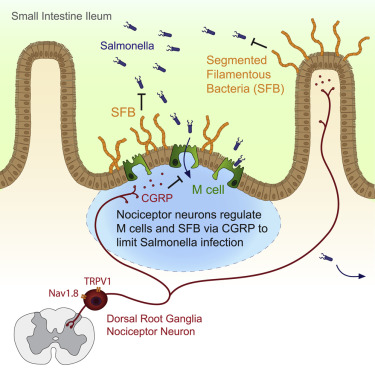
但新研究发现,当它们纤长的触手在肠道中捕捉到致病菌的蛛丝马迹时,痛觉神经元会亲临指挥,释放肽类神经递质(降钙素基因相关肽,CGRP)通知M细胞“关紧大门”。这也会使肠道中专克沙门氏菌的一种益生菌(segmentous filamentous bacteria, SFB)大量繁殖,它们会用粘液帮肠道一起抵抗敌害。
研究者们首先用敲除实验证实,在肠道内的众多神经元中,只有主角神经元能帮小鼠抵御病菌;并且它们的存在与否会影响M细胞的密度和益生菌的数量,但不影响其它免疫细胞和肠道上皮细胞的功能。利用先天缺乏益生菌的小鼠,研究者用益生菌灌肠实验说明了该益生菌能抵抗沙门氏菌感染。而选择性地减少M细胞则能增加该益生菌数量。
最后,他们观察到,病菌确实能直接激活痛觉神经元:钙离子内流,神经递质释放。这些痛觉神经元释放的是神经肽——由几十个氨基酸组成的类似蛋白质的信号分子,而其中一种(CGRPα)确实可以调节M细胞和益生菌数量。
本研究揭示了感觉神经元也可以直接与神经系统以外的细胞沟通,发挥免疫功能,有潜力发展为药物靶点。看来不仅仅肠道微生物可以对你的脑子产生影响,中枢神经系统也是很关心消化道里的小家伙们的呢。
研究还留下了一些未解决的谜团。如痛觉神经元探测沙门氏菌的具体机制(猜测是有致病菌分子的受体)、释放的神经肽如何调节M细胞数量(猜测是影响其分裂的胞内信号通路)、M细胞数量又为何能影响益生菌数量(可能益生菌不喜欢附着在M细胞上)?
有趣的是,虽然肠道内有多种神经元,有些来自脊髓背神经节、有些来自肠道自己的神经系统、有些来自迷走神经,但只有来自脊髓的痛觉神经元才有防御沙门氏菌的功能。为什么肠道不用自己的神经元,而要靠“空降”的脊髓背角神经元来防御呢?而且这是一个感觉神经元,信息可能也没经过脊髓神经中枢的处理。这究竟是进化的巧合,还是肠道有意被剥夺了独立性呢?
本研究来自哈佛大学医学院的Isaac M. Chiu课题组,文章发表于《细胞》(Cell),题为“Gut-Innervating Nociceptor Neurons Regulate Peyer’s Patch Microfold Cells and SFB Levels to Mediate Salmonella Host Defense”。
参见
- 雪月. BioArt: Cell | 神经系统调控肠道抗感染能力. https://www.linkresearcher.com/theses/9cfae586-4dc1-40ca-b0c2-e1077f9953a6
- ‘Stomach-ache’ neurons rush to the rescue when bacteria invade. https://www.nature.com/articles/d41586-019-03725-8
解读:顾金涛;编辑:阿莫東森
















评论