今年的诺贝尔生理学或医学奖表彰了维克多·安布罗斯(Victor Ambros)和加里·鲁夫坤(Gary Ruvkun),他们发现了调控基因活动的一个基本原理。每个细胞都包含相同的染色体,因此每个细胞都拥有完全相同的一套基因和指令。然而,肌肉细胞和神经细胞等不同的细胞类型却表现出非常不同的特征。这些差异是如何产生的呢?答案在于基因调控,它使每个细胞能够选择与自身相关的指令,从而确保每种细胞类型中只有正确的一组基因被激活。安布罗斯和鲁夫坤对不同细胞类型的发育过程感兴趣。他们发现了microRNA,这是一类在基因调控中起关键作用的微小RNA分子。这一突破性发现揭示了一种全新的基因调控原理,事实证明它对包括人类在内的多细胞生物至关重要。现在已知,人类基因组编码了超过一千种microRNA。他们的惊人发现揭示了基因调控的一个全新维度,microRNA在生物体的发育和功能中起着根本性的作用。

多细胞生物从单细胞祖先进化而来,在这一过程中,不同的细胞类型逐渐获得了特定的功能,这要求越来越复杂的基因调控机制。除了通过DNA结合因子作用于调控序列的转录性基因调控外,随着生物体复杂度的增加,其他形式的控制系统也逐渐出现。在数亿年的进化过程中,编码微小非编码RNA分子(即microRNA)的基因在多细胞生物的基因组中扩展,负责对mRNA的稳定性和蛋白质翻译进行转录后控制。microRNA及其基因调控模式在1993年维克多·安布罗斯(Victor Ambros)和加里·鲁夫坤(Gary Ruvkun)发现之前,完全未知。这两位诺贝尔奖得主研究了发育缺陷的突变线虫(C. elegans),这些缺陷是由lin-4和lin-14基因位点的改变引起的。安布罗斯的实验室克隆了lin-4基因,并意外发现它并不编码蛋白质,而是编码了一段22个核苷酸的非编码RNA。与此同时,鲁夫坤的实验室发现lin-4通过其3’非翻译区(3’UTR)的多个元件调控lin-14。通过比较序列信息,他们发现了短的非编码lin-4 RNA与lin-14的3’UTR元件之间存在部分序列互补。这首次揭示了一种概念上新颖的调控RNA类型:microRNA。2000年,鲁夫坤的实验室发现了高度保守的let-7 microRNA,随后在多种动物物种(包括人类)中鉴定出同源的microRNA。这激发了对整个动物界microRNA的大规模克隆和测序工作,最终发现microRNA是一个庞大的调控群体,负责控制大量编码蛋白质基因的网络。安布罗斯和鲁夫坤的发现完全出乎意料,揭示了一个由microRNA介导的进化上保守的转录后调控机制,它在动物发育和成年组织功能中发挥着关键作用。
引言
基因在何时何地转录成RNA并翻译成蛋白质的控制,是生命的一个基本方面。例如,胰岛素只在胰腺的β细胞中产生,而视蛋白则在眼睛的视网膜中产生。特定细胞类型基因调控的精确指令编码在遗传物质中,由序列特异性的DNA结合蛋白执行。1965年,弗朗索瓦·雅各布(François Jacob)和雅克·莫诺(Jacque Monod)因发现基因的调控机制而获得诺贝尔生理学或医学奖。DNA结合转录因子库在单细胞和多细胞真核生物之间高度保守,而多细胞生物中出现了额外的基因调控层,以确保在每种细胞类型中正确生成RNA和蛋白质。
真核模式生物在遗传学研究中具有无可替代的价值,带来了许多意想不到的发现。悉尼·布伦纳(Sydney Brenner)在五十多年前引入了线虫(Caenorhabditis elegans,简称C. elegans)作为研究对象。由于这种生物具有较短的世代时间、透明性以及易于进行遗传操作的特点,它成为了广泛研究的对象。悉尼·布伦纳、约翰·萨尔斯顿(John Sulston)和罗伯特·霍维茨(Robert Horvitz)使用C. elegans揭示了细胞分裂、分化和细胞死亡如何在器官发育过程中受到基因控制,并因此获得了2002年诺贝尔生理学或医学奖。
1970年代,布伦纳实验室通过C. elegans的诱变筛选发现了lin-4突变体(e912)。这些线虫表现出显著的表型:许多细胞类型和形态结构完全缺失,卵子因生殖器官发育失败而积累(Horvitz和Sulston,1980;Chalfie,Horvitz和Sulston,1981),这似乎是由于某些细胞谱系的发育程序重复导致的。lin-4突变体中观察到的线虫发育严重受阻,表明lin-4可能编码一个发育时序的主调控因子。此外,还鉴定出大量其他异时性突变体,它们表现出各种发育时间上的缺陷,包括由霍维茨实验室发现的另一个突变体lin-14(Ferguson,Sternberg和Horvitz,1987)。
与此同时,维克多·安布罗斯在完成关于脊髓灰质炎病毒基因组结构与复制的博士学位后,加入了霍维茨实验室。作为博士后,安布罗斯立即投入到对异时性突变体的遗传分析中,并确定lin-14突变体具有与lin-4突变体相反的发育时序缺陷。在lin-14突变体中,幼虫阶段的程序完全缺失(Ambros和Horvitz,1984)。特别值得注意的是,安布罗斯后来发现lin-4是lin-14的负调控因子(Ambros,1989)。
在这一时期,加里·鲁夫坤在弗雷德里克·奥苏贝尔(Frederick Ausubel)的指导下完成了他的细菌遗传学博士学位。欧洲旅行期间,他在了解到异时性突变体的细胞谱系分析后,对线虫遗传学产生了兴趣(Chalfie,Horvitz和Sulston,1981;Ruvkun,Wightman和Ha,2004)。与马丁·查菲(Martin Chalfie)和罗伯特·霍维茨的讨论进一步激发了他使用C. elegans研究这些问题的兴趣。1982年,鲁夫坤开始在沃尔特·吉尔伯特(Walter Gilbert)和罗伯特·霍维茨实验室间开展博士后研究。
通过microRNA的转录后基因调控的发现
在霍维茨实验室,安布罗斯和鲁夫坤开始了克隆lin-14基因的长期探索。当时,使用遗传学定义的位点来确定DNA序列是一项极具挑战性的任务。经过数年的坚持不懈实验,他们成功使用经典的限制性片段长度多态性(RFLP)方法鉴定了该区域(Ruvkun等,1989)。在此期间,安布罗斯和鲁夫坤均获得了教职,安布罗斯在哈佛大学任职,而鲁夫坤则在马萨诸塞总医院和哈佛医学院担任职务。他们继续进行分子分析。鲁夫坤证明lin-14是一种核蛋白,在发育中表现出阶段特异性表达,主要在L1阶段表达,并在lin-4和lin-14突变体中表现出改变(Ruvkun和Giusto,1989)。有趣的是,发现了一些在3’UTR中存在缺失的lin-14功能获得性突变体(Ruvkun和Giusto,1989;Wightman等,1991),导致lin-14蛋白在L1阶段之后仍然持续检测到(Arasu,Wightman和Ruvkun,1991;Wightman等,1991)。3’UTR元件的破坏并未影响蛋白质序列,因此鲁夫坤推测,mRNA稳定性、核输出或翻译上的一种转录后机制可能介导了lin-14的时间切换(Wightman等,1991)。
相比之下,仅发现了一个lin-4突变体(e912)。安布罗斯实验室开始通过RFLP和Southern blot方法克隆lin-4基因。他们通过逐步缩小染色体区域的“步行”策略,并迭代测试较小的基因组片段以恢复lin-4突变体的表型,最终确定了一个693 bp的Sal I限制性酶片段。经过多轮开放阅读框预测和克隆重测序以排除错误,他们开始怀疑lin-4基因可能是一个非编码RNA,因为它的开放阅读框非常短。引入C. elegans序列的移码突变并未影响lin-4功能,证实了这一猜测。1991年,实验室通过Northern blot和RNA酶保护实验对lin-4转录物进行了探测,发现了两种分别为61和22个核苷酸(nt)的短RNA转录物。
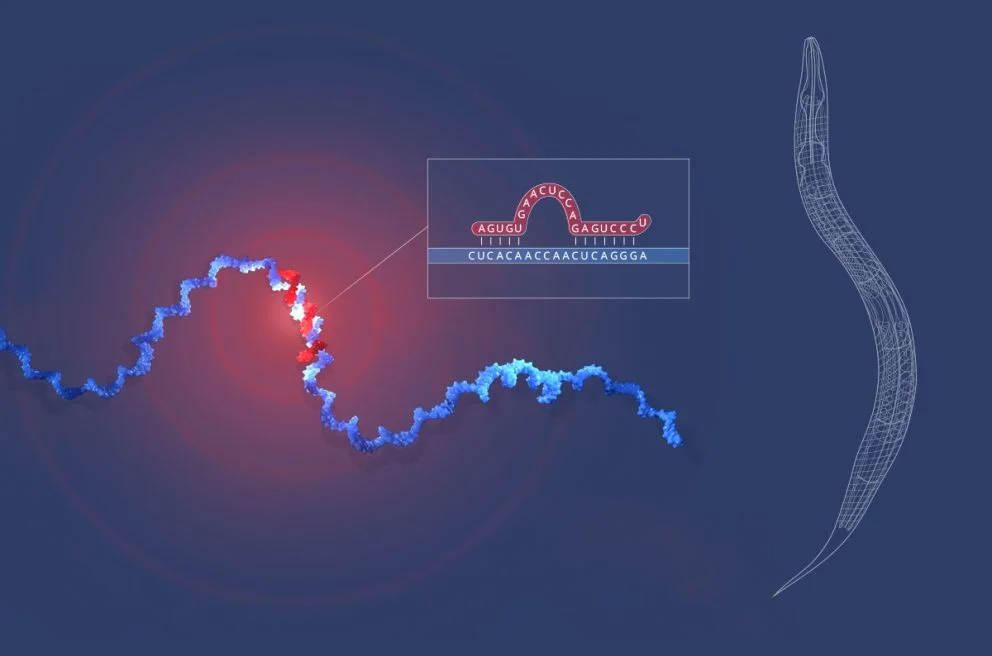
在各自实验室分别推导出lin-4(安布罗斯实验室)和lin-14(鲁夫坤实验室)的序列后,1992年6月11日晚上,安布罗斯和鲁夫坤交换了lin-4和lin-14基因的序列数据。双方都注意到lin-4非编码RNA与lin-14 3’UTR中的多个元件之间存在显著的部分互补性。
认识到这一发现的重要性,两位的实验室进行了大量额外实验,证明lin-4 microRNA通过与位于lin-14 3’UTR的元件碱基配对来调控lin-14 mRNA。他们的开创性发现于1993年在《Cell》杂志上发表了两篇背靠背论文(Lee,Feinbaum和Ambros,1993;Wightman,Ha和Ruvkun,1993)。
安布罗斯的实验室使用C. elegans lin-4序列,在其他线虫物种中鉴定了相应的lin-4克隆(C. briggsae,C. remanei和C. vulgaris)。这些实验表明,来自其他线虫的lin-4克隆可以在C. elegans中拯救lin-4突变体表型。他们还筛选了超过2万条诱变染色体,鉴定出第二个lin-4突变体(ma161),该突变体包含一个单核苷酸突变。值得注意的是,这个突变存在于互补序列内,进一步支持了lin-4 microRNA与lin-14 3’UTR元件之间互补碱基的功能重要性(Lee,Feinbaum和Ambros,1993)。
鲁夫坤的实验室比较了野生型和lin-14功能获得性突变体中的lin-14蛋白和RNA的含量。结果显示,突变体中的lin-14蛋白含量提高了4到7倍,而RNA含量没有变化,这证明lin-14是通过转录后水平(即RNA转录后)受到调控的。将lin-14的3’UTR转移到报告基因中,观察到报告基因的转录后调控模式与lin-14相似,证明了3’UTR本身足以控制mRNA翻译。通过反复缩小lin-14 3’UTR的片段,最终确定了一个功能性124个核苷酸长的3’UTR片段。这个片段包含多个与lin-4部分互补的序列,并且该片段在另一种线虫C. briggsae中也得到了保守(Wightman,Ha和Ruvkun,1993)。
计算分析发现,lin-4 microRNA与各种物种的核苷酸数据库中的序列进行匹配时,只在其他线虫中发现了匹配序列,如C. briggsae。一个关键问题随之而来:microRNA的存在是否仅是线虫特有的现象,还是它在整个动物王国中具有保守且广泛的功能?
let-7 microRNA的发现及其进化保守性
在发现第一个microRNA lin-4之后,七年过去了,第二个microRNA基因let-7才被发现。鲁夫坤实验室进行了遗传筛选,重点研究了能够抑制携带lin-14和egl-35突变的合成不育表型的突变体(Reinhart等,2000)。let-7基因编码一段21个核苷酸的RNA,该RNA与多个异时性基因的3’UTR具有互补性,包括lin-14、lin-28、lin-41、lin-42和daf-12。let-7的缺失导致成虫阶段重复幼虫的细胞命运。这一第二个microRNA基因的发现表明,microRNA可能在发育过程中调控细胞谱系形成的时序中发挥更广泛的作用。
随后,鲁夫坤实验室的另一重大突破表明,let-7基因与lin-4不同,在广泛的动物中具有进化保守性。通过将let-7 microRNA序列与核苷酸数据库进行比较,发现其在人类和果蝇中都有匹配的序列(Pasquinelli等,2000)。let-7在线虫中的一个已知靶标是lin-41蛋白,而其同源蛋白在斑马鱼和果蝇中也存在。令人放心的是,斑马鱼和果蝇的lin-41同源蛋白的3’UTR同样与let-7具有互补性(Pasquinelli等,2000)。此外,let-7 microRNA在人类的多个组织中都有发现,表明它在哺乳动物细胞的基因表达中具有重要作用。
与线虫类似,果蝇发育过程中的分析也显示了let-7 microRNA的时间性调控,表明let-7在昆虫、甲壳动物和线虫中具有保守的功能(Pasquinelli等,2000)。值得注意的是,甚至在软体动物和环节动物等不经过幼虫阶段发育的物种中,也检测到了let-7的时间性表达。此外,脊椎动物虽然没有明显的幼虫阶段,但在发育过程中,包括成年斑马鱼在内的多个阶段,仍表现出let-7的时间性表达。令人惊讶的是,let-7表达在双侧对称动物(即左右对称的动物)中具有时间调控,这可能是在这些动物与具有双胚层的物种(如水母等)分化之后进化出来的。let-7的进化保守性极大地增加了人们对microRNA作为基因表达转录后调控因子的兴趣。
在发现let-7之后,多个研究实验室开始通过小RNA克隆方法在人类和其他物种中鉴定其他microRNA。托马斯·图施尔(Thomas Tuschl)的实验室从人类和果蝇组织中克隆了新的microRNA(Lagos-Quintana等,2001),大卫·巴特尔(David Bartel)的实验室从线虫中分离出了新的microRNA(Lau等,2001),安布罗斯实验室也进行了类似的工作(Lee和Ambros,2001)。所有证据表明,microRNA是一个庞大的调控类群,存在于整个动物界,可能在基因调控中发挥着重要作用。分子生物学技术和测序技术的进步使得科学家们在人体基因组中发现了超过1000个microRNA基因。目前,microRNA基因数据库miRBase已经收录了超过38000个发夹前体和48860个成熟的microRNA基因序列,覆盖271个物种(Kozomara,Birgaoanu和Griffiths-Jones,2019)。甚至病毒中也发现了编码microRNA的基因(Pfeffer等,2004)。
随着microRNA的进一步克隆及整个基因组序列的可用性,研究人员有更多机会定义microRNA与3’UTR区域之间的碱基配对规则。David Bartel、Christopher Burge和Stephen Cohen实验室的关键研究(Lewis等,2003;Stark等,2003;Brennecke等,2005;Lewis,Burge和Bartel,2005)结合实验和比较基因组学方法,阐明了microRNA靶标识别的整体规则。研究表明,microRNA通常与其靶标mRNA具有部分互补性,尤其是在microRNA的“种子”区域。这项工作还揭示出每个microRNA可能调控多个编码蛋白质的基因,因为许多3’UTR片段展现出与microRNA种子序列互补的过度保守性(Brennecke等,2005;Lewis,Burge和Bartel,2005)。
这些研究进一步证明了microRNA在细胞谱系形成和细胞类型稳定性中具有重要作用。特别是,研究发现,与某种特定microRNA在同一细胞类型或谱系中共表达的基因往往缺乏该microRNA的靶位点,而这些靶位点则常见于在相邻细胞或组织中表达的基因中(Farh等,2005;Stark等,2005)。这些观察结果进一步支持了microRNA在多细胞生物中控制细胞命运形成和维持中的重要功能。
microRNA的生成与功能
随着越来越多的microRNA基因被克隆,多个研究团队也投入了对microRNA生成及其作用机制的研究(Bartel,2004)。microRNA基因的转录策略多种多样。有些microRNA基因是独立的转录单元,有时成簇分布,而另一些则位于编码蛋白质基因的内含子中。经典的初级microRNA(pri-microRNA)由RNA聚合酶II转录,具有发夹结构。这种发夹结构在细胞核中被微处理复合物(Microprocessor)识别,Microprocessor由Drosha核酸内切酶等组成,切割双链RNA生成大约60到70个核苷酸长的前体microRNA(pre-microRNA),这是最早在安布罗斯实验室检测到的。随后,Exportin 5和RAN-GTP将pre-microRNA运输到细胞质中。Dicer核酸内切酶(最早在Greg Hannon实验室中发现)进一步处理形成microRNA双链。有效的microRNA链会加载到包含Argonaute蛋白的沉默复合物中,而另一条“乘客”链则被移除(Schwarz等,2003)。一旦microRNA链加载到沉默复合物中,它可以通过碱基序列的特异性与mRNA结合,从而抑制mRNA的翻译或促进mRNA降解。这种调控依赖于TNRC6适配蛋白和多聚A结合蛋白PABPC,它们招募去腺苷化酶复合物缩短mRNA的polyA尾部,最终导致mRNA降解或翻译抑制,具体效果取决于细胞的发育阶段和类型。
用于处理和执行microRNA功能的机器也被其他RNA沉默机制所使用,这些机制统称为RNA干扰(RNAi),包括小干扰RNA(siRNA)、内源性Piwi相关RNA(piRNA)和重复相关小干扰RNA(rasiRNA)。1998年,Andrew Fire和Craig Mello发现双链RNA能够诱导序列依赖的基因沉默,这一发现使他们在2006年获得了诺贝尔生理学或医学奖。RNAi主要在植物和低等动物中作为对抗病毒感染和不必要基因组活动的防御机制,而microRNA则通过与mRNA序列部分互补,负责调控发育和成年细胞类型中的基因表达。而例如siRNA等通常是外源性分子,它们与特定的RNA靶序列完全互补并促使其被切割。1999年,大卫·鲍尔库姆(David Baulcombe)证明了植物中的转录后基因沉默涉及短RNA与靶序列的特异性配对处理(Hamilton和Baulcombe,1999),进一步将不同领域的观察结果联系起来。
microRNA的进化与生理功能
microRNA基因的出现和扩展与更复杂生物的进化密切相关。在早期两侧对称动物进化过程中,microRNA基因的数量显著增加(Grimson等,2008;Wheeler等,2009),推测其功能出现在两侧对称动物的最后共同祖先中,这些基因在原口动物和后口动物分化之前已经发挥作用(Christodoulou等,2010)。自那时起,随着更为复杂的生物体和特化细胞类型的出现,又增加了数百个microRNA基因。甚至在早期多细胞动物海绵、植物以及某些单细胞真核生物中也鉴定出了microRNA基因。因此,人们推测microRNA可能在多个进化阶段独立出现,包括大约6亿年前的早期多细胞动物,或者在植物和动物的共同祖先中大约10亿年前已进化出microRNA(Moran等,2017)。值得注意的是,许多进化上古老的microRNA基因在后续进化中得以保留,表明它们在基因调控中具有关键作用。
microRNA在多细胞生物发育及组织功能中的重要性,通过破坏microRNA生成途径的实验得到了证明。Dicer是负责在细胞质中处理pre-microRNA的酶,在小鼠和斑马鱼中删除Dicer会导致胚胎致死(Bernstein等,2003;Wienholds等,2003)。删除果蝇和小鼠中的个别或成簇的microRNA基因也会引起强烈的表型(Bartel,2018)。然而,个别microRNA基因的功能有时不明显,可能是由于多个microRNA基因共享靶标的种子序列而具有冗余性。这种冗余不仅对研究单个microRNA基因的功能构成了挑战,也展示了这个系统的稳健性,解释了为何它难以通过例如病毒等方式轻易被操控。
值得强调的是,进化上最保守的microRNA基因(那些在两侧对称动物中保留的基因)通常在胚胎发育早期起作用,而特定于哺乳动物的microRNA基因则更多地在胚胎发育的后期阶段发挥功能(DeVeale,Swindlehurst-Chan和Blelloch,2021)。与此相对,特定物种的microRNA基因通常在成年细胞类型中起作用,而非在胚胎发育中。这些模式在系统性microRNA基因敲除实验中得到了验证。microRNA在动物发育中的特定调控角色包括发育时序、细胞命运的形成与稳定、一般生理功能及体内平衡(DeVeale,Swindlehurst-Chan和Blelloch,2021)。
通过选择性删除小鼠中的Dicer,研究人员进一步揭示了microRNA在成年细胞和组织中的功能。例如,早期删除B细胞发育过程中Dicer1导致其分化在前B细胞阶段停滞(Koralov等,2008)。在胚胎第15.5天的神经元中删除Dicer1导致小鼠在出生后不久死亡,表现为小头畸形、树突分支减少和树突棘长度增加(Davis等,2008)。在出生两周的小脑浦肯野细胞中,失去Dicer1会引发小脑退化和共济失调(肌肉协调障碍)(Schaefer等,2007)。类似地,在中脑多巴胺能神经元中删除Dicer1会导致神经元逐渐丧失及运动能力下降(Kim等,2007)。在其他几种细胞类型和组织中也观察到严重表型,进一步证明了microRNA在发育过程及成年细胞类型功能中的关键作用。
microRNA对人类发育及功能的重要性通过与特定microRNA基因或生成途径相关的综合征得到了体现。DICER1综合征是一种罕见的遗传性疾病,由DICER1基因突变引起,患者易患肾脏、甲状腺、卵巢、宫颈、睾丸、大脑、眼睛和肺部肿瘤。通常,这些患者的一个DICER1等位基因携带使其失去功能的生殖系突变,导致细胞中功能性DICER1蛋白的减少。这些个体容易发生额外的体细胞突变,因此常在儿童期发生肿瘤(Foulkes,Priest和Duchaine,2014)。
个别microRNA基因的种子区域较短,因此其序列被随机突变改变的可能性较小。然而,已知某些种子序列的突变与疾病相关。例如,miRNA-96的突变与渐进性听力丧失有关(Mencía等,2009;Soldà等,2012),miRNA-184的突变导致EDICT综合征,这是一种罕见的眼部疾病,表现为虹膜发育不全、角膜内皮营养不良和先天性白内障(Hughes等,2011;Iliff,Riazuddin和Gottsch,2012;Lechner等,2013),而miRNA-140-5p的突变会引起先天性骨骼疾病(Grigelioniene等,2019)。针对代谢紊乱、心血管疾病、神经退行性疾病和癌症等疾病的microRNA诊断和治疗技术正在取得进展。
编译来源:https://www.nobelprize.org/prizes/medicine/2024/advanced-information/












评论